Neurochemická podstata schizofrénie
- Dopamínová hypotéza je aj naďalej platnou neurobiologickou teóriou schizofrénie.1, 2
- Dopamínové receptory zapojené do patofyziológie schizofrénie majú v ľudskom mozgu rôznu distribúciu, afinitu a vlastnosti.
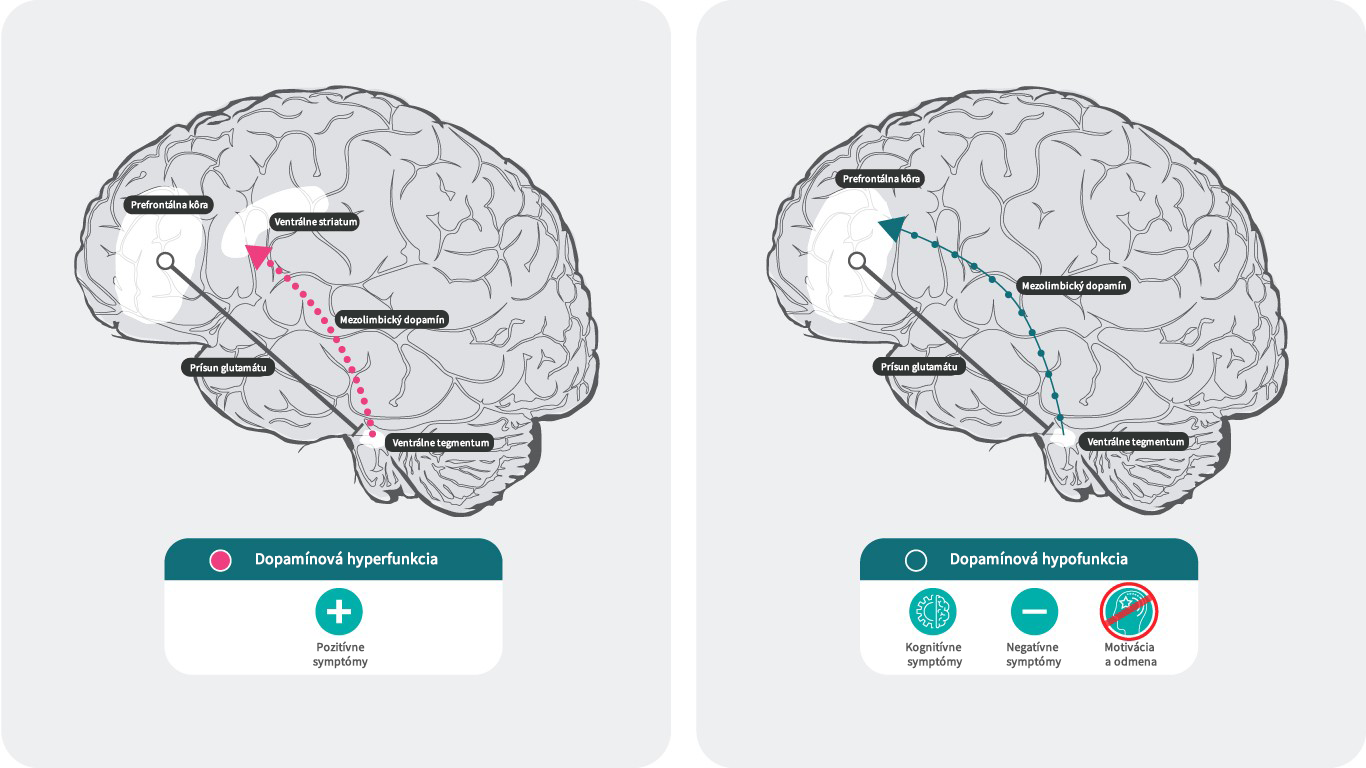
- Pri schizofrénii sa predpokladá, že pozitívne príznaky súvisia s hyperdopaminergným stavom v mezolimbickom systéme, zatiaľ čo hypodopaminergný stav v mezokortexe je spojený s negatívnymi a kognitívnymi symptómami.
V tejto časti
Dopamínová hypotéza
Dopamínová hypotéza schizofrénie vznikla ako teória vychádzajúca z nepriamych dôkazov pochádzajúcich z klinického pozorovania po antipsychotickej liečbe a pokročila až do súčasného stavu, kedy zobrazovacie vyšetrenia umožňujú priame testovanie a validáciu a umožňujú lepšie pochopiť príčinné patofyziologické mechanizmy schizofrénie.3
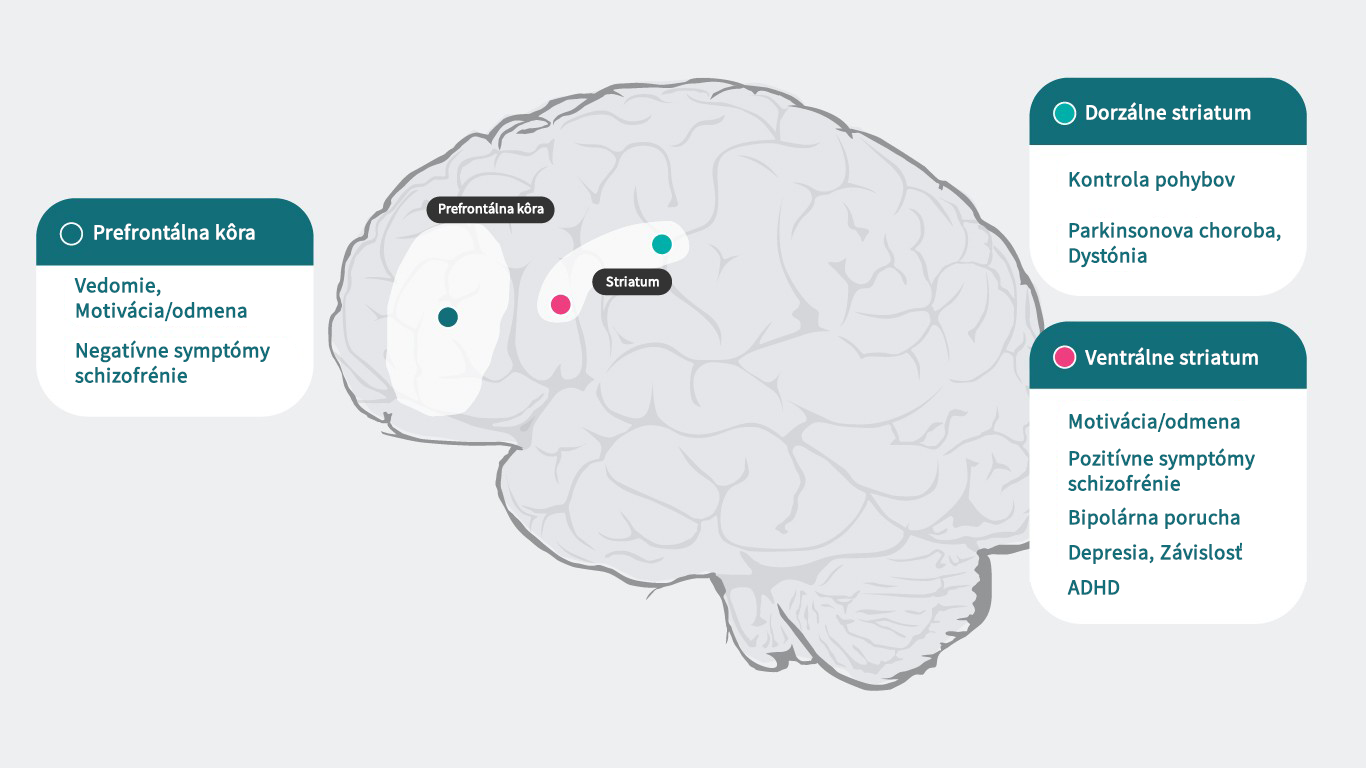
Dopamín a živý mozog
Vzhľadom na to, že dopamín pôsobí špecificky na každom podtype svojich receptorov, ktoré sú zodpovedné za širokú škálu psychiatrických a neurologických funkcií (prefrontálny kortex: kognícia,5 motivácia/odmeňovanie6 – 10, negatívne symptómy schizofrénie11, dorzálne striatum: kontrola motoriky,12 Parkinsonova choroba1, dystónia,1 ventrálne striatum: motivácia/odmeňovanie,6 – 10 pozitívne symptómy schizofrénie,11, 13 bipolárna porucha,14
depresia,8 návykové správanie,15 ADHD16), môže viesť narušenie týchto procesov k viacerým príznakom spojených s psychiatrickým ochorením. Psychotropné lieky, ktoré ovplyvňujú aktivitu dopamínových receptorov, môžu viacero týchto symptómov zmierňovať, ale na úplné pochopenie, ako antipsychotiká ovplyvňujú dopaminergnú neurotransmisiu a liečia schizofréniu, potrebujeme lepšie poznať funkcie dopamínu v rôznych štruktúrach mozgu a mechanizmus zodpovedný za schizofréniu.
Literatúra: Upraveno podle Stahl SM. Essential Pharmacology 4th edition 20131 ; Cools R, D’Esposito M. Biol Psychiatry. 2011;69(12):e113-125.5; Hamid AA, et al. Nat Neurosci. 2016;19(1):117-126.6; Koob GF, et al. NIDA Res Monogr. 1994;145:1–187; Biesdorf C, et al. Neurobiol Learn Mem. 2015;123:125-1398; Der-Avakian A, et al. Trends Neurosci. 2012 Jan;35(1):68-77.9; Leggio GM, et al. Eur Neuropsychopharmacol. 2008 Apr;18(4):271-7.10; Stahl SM. Prim Care Companion J Clin Psychiatry.2003;5(3)9-1311; Plowman EK, et al. J Parkinsons Dis. 2011;1(1):93-10012; Dichter GS, et al. J Neurodev Disord. 2012;4:19513; Ashok AH, et al. Mol Psychiatry.2017 May;22(5):666–67914; Orio L, et al. Addict Biol. 2010;15(3):312-32315; Volkow ND, et al. J Neurosci. 2012;32(3):841-84916.
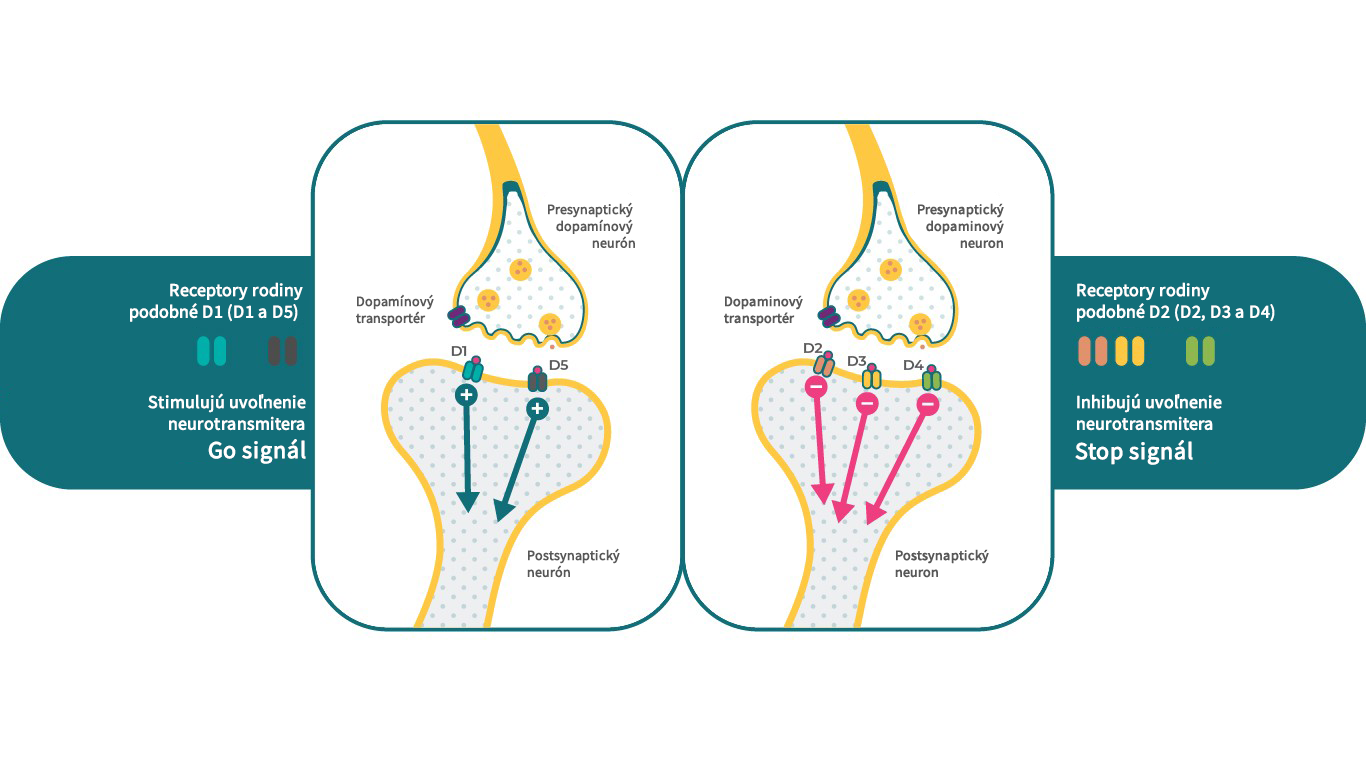
Podtypy dopamínových receptorov
Existuje 5 typov dopamínových receptorov, ktoré možno rozdeliť do 2 hlavných tried. Do skupiny D1-like receptorov patria dopamínové D1 a D5 receptory a do skupiny D2-like receptorov patria D2, D3 a D4 receptory. Z klinického pohľadu sú dopamínové D2, D3 a D1 receptory vo všeobecnosti považované za receptory s najužším vzťahom k schizofrénii. Podľa podtypu môžu dopamínové receptory vykazovať rôzne účinky na rovnaký systém sekundárnych messengerov, kedy jeden receptor slúži ako signál stop a iné receptory fungujú ako signál štart.4 Napríklad D1 receptory môžu stimulovať cAMP, zatiaľ čo D2 a D3 receptory môžu tohto sekundárneho messengera inhibovať.
Týmto spôsobom môžu D1, D2 a D3 receptory v prítomnosti dopamínu spúšťať veľmi špecifické, ale zároveň odlišné neurobiologické funkcie, čo umožňuje jedinému neurotransmiteru ovplyvňovať rôzne fyziologické, behaviorálne a patologické stavy.4, 17
Literatúra: Upraveno podle Stahl, S. M. Dazzled by the dominions of dopamine: Clinical roles of D3, D2, and D1 receptors. CNS Spectr. 22, 305–311 (2017)4
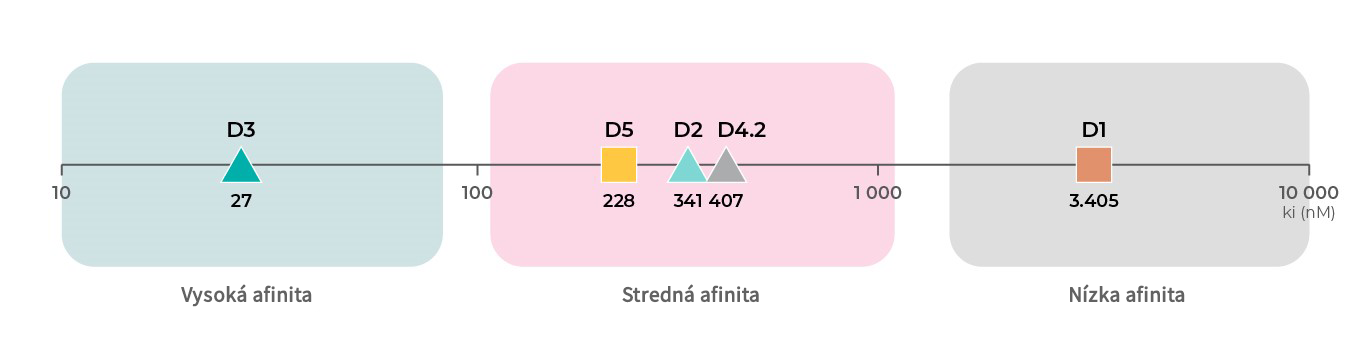
Afinita dopamínových receptorov
Okrem rôznych funkcií jednotlivých podtypov dopamínových receptorov má každý podtyp týchto receptorov inú afinitu k dopamínu. Podľa údajov o väzbe z databázy PDSP Ki majú najvyššiu afinitu k dopamínu D3 receptory, nasledujú D2 receptory19, 20, D4 receptory21 a D5 receptory18 so strednou afinitou a potom D1 receptory18, 19 s najnižšou afinitou k dopamínu.4
Literatúra: Všechny údaje o vazbách pocházejí z databáze PDSP Ki.
Affinity to D1 subtype: Toll L, NIDA Res Monogr 1998, 178:44046619 ; Sunahara RK, Nature 1991, 350:614-61918
Affinity to D2 subtype: Michaelides MR 1995, J Med Chem 38:3445-344720; Toll L, NIDA Res Monogr 1998, 178:44046619
Affinity to D3 subtype: Toll L, NIDA Res Monogr 1998, 178:44046619; Cussac D, Naunyn Schmied Arch Pharmacol 2000, 361:569-572;
Affinity to D4 subtype: Tallman JF, J Pharm Exp Ther 1997, 282:1011-101921;
Affinity to D5 subtype: Sunahara RK, Nature 1991, 350:614-61918; Stahl SM, CNS Spect 2016, 21:123-12722.
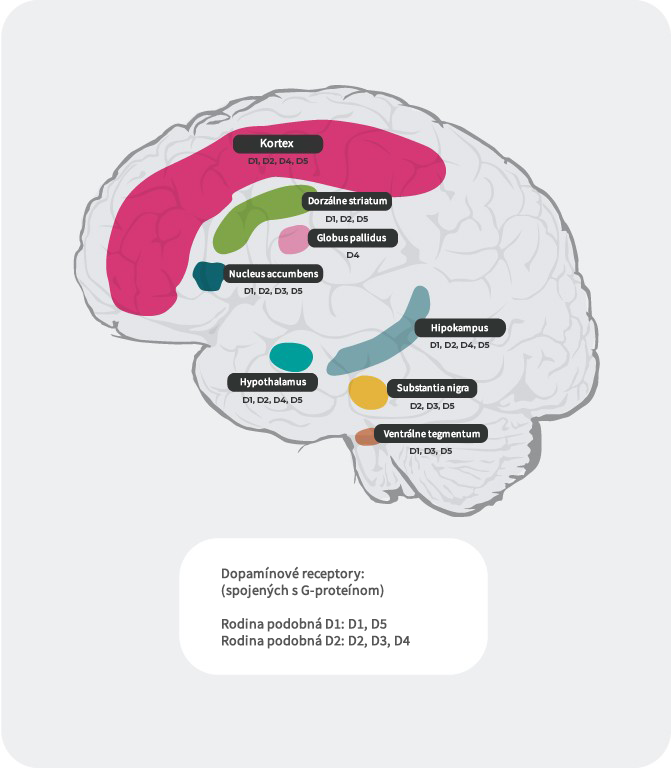
Distribúcia dopamínových receptorov4, 22 – 27
Okrem rôznej afinity sa líši aj distribúcia podtypov dopamínových receptorov v rôznych častiach mozgu. Napríklad nadmerné vyplavenie dopamínu na postsynaptických D2 receptoroch vo ventrálnom striate zrejme vyvoláva pozitívne symptómy psychózy. Preto dopamínové D2 receptory predstavujú primárny cieľ väčšiny antipsychotík používaných pri liečbe schizofrénie. D3 receptory sú vysoko exprimované v limbických oblastiach, v hypotalame a ventrálnej tegmentálnej oblasti/substancia nigra, v oblastiach, o ktorých sa predpokladá, že sú zapojené do regulácie kognície, nálady a motivácie. V prefrontálnom kortexe, kde je expresia dopamínových D2 a D3 receptorov nízka, je dopaminergná neurotransmisia viac kontrolovaná postsynaptickými D1 receptormi.
Literatúra: Upraveno podle Stahl, CNS spec. 2017;22:305-311 18; Fatemi SH. The medical basis of psychiatry. 4th edition. Sringer 2016;p93-9427
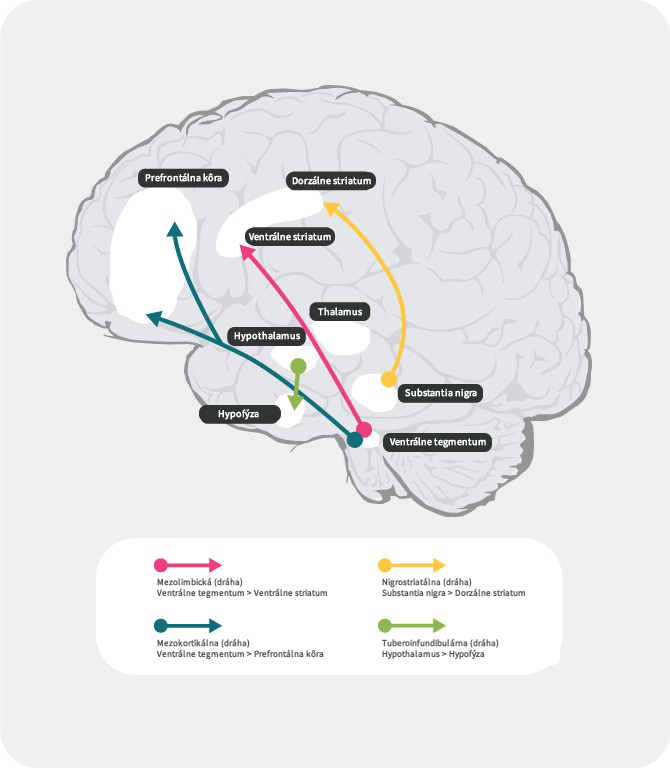
Dopaminergné dráhy
V ľudskom mozgu existujú 4 hlavné dopaminergné dráhy: mezolimbická, mezokortikálna, nigrostriatálna a tuberoinfundibulárna:27
mezolimbická dráha: mezolimbická dráha, známa tiež ako dráha odmeny, prenáša dopamín z ventrálnej tegmentálnej oblasti (VTA) do ventrálneho striata. Ventrálna tegmentálna oblasť sa nachádza v strednom mozgu a ventrálne striatum v prednom mozgu a zahŕňa nucleus accumbens a tuberculum olfactorium.
mezokortikálna dráha: mezokortikálna dráha je údajne zapojená do kognitívnych funkcií a emócií, prenáša dopamín z ventrálnej tegmentálnej oblasti do prefrontálneho kortexu.
nigrostriatálna dráha: nigrostriatálna dráha je zapojená do regulácie pohybov a prenáša dopamín z pars compacta substancia nigra (SNc), ktorá sa nachádza v strednom mozgu, do nucleus cautum a putamen, ktoré sú uložené v dorzálnom striate
tuberoinfundibulárna dráha: tuberoinfundibulárna dráha prenáša dopamín z nucleus infundibularis do hypofýzy. Táto dráha riadi sekréciu hypofyzárnych hormónov vrátane prolaktínu.
Literatúra: Upraveno podle Fatemi SH. The medical basis of psychiatry. 4th edition. Sringer 2016;p93-9427
Dopamín a schizofrénia28,29
Podľa dopamínovej hypotézy schizofrénie súvisí nadmerná dopaminergná neurotransmisia v subkortikálnej a limbickej oblasti s pozitívnymi symptómami,30 zatiaľ čo nedostatočná mezokortikálna dopaminergná projekcia do prefrontálneho kortexu môže byť zodpovedná za negatívne symptómy a kognitívne poruchy.31, 32
Literatúra: Upraveno podle Stahl SM. 4th ed. New York, NY: Cambridge University Press; 20131; Howes J Psychopharmacol. 2015 February; 29(2): 97–115.; 35. Elert E, Nature 2014. 508. s2-s329
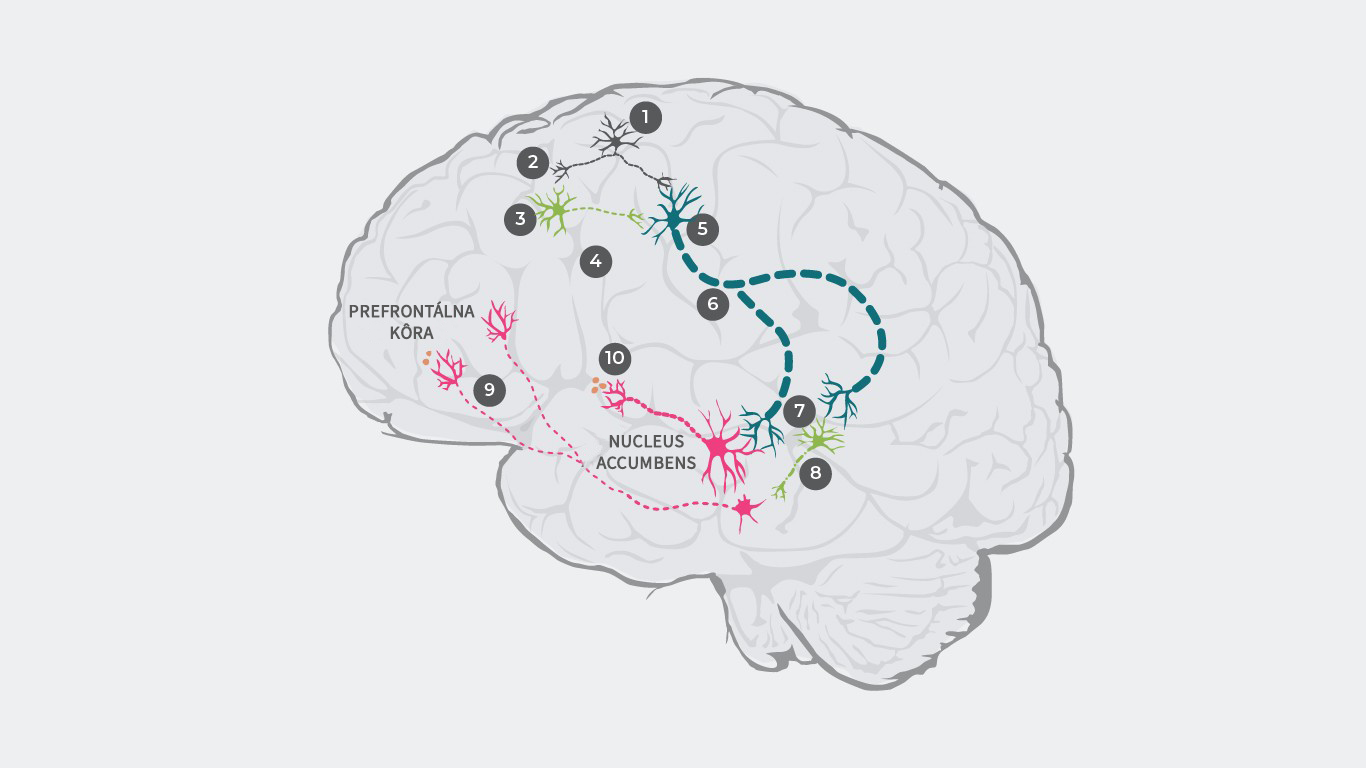
Na vysvetlenie patofyziológie schizofrénie bolo navrhnutých niekoľko teórií dopaminergnej dysregulácie.33, 34 Napríklad podľa výskumu môže byť patofyziológia schizofrénie primárne vyvolaná dysreguláciou glutamátu, ktorá vedie k dopaminergnej dysbalancii.35
Kaskáda začína aktiváciu glutamátových neurónov a vyslaním elektrického pulzu (1), ktorý vedie k vyplaveniu glutamátu na synapsiu (2).
U zdravého človeka sa potom glutamát viaže na receptory inhibičných GABA neurónov a excitačných glutamátových neurónov. U pacientov so schizofréniou je však väzba glutamátu na GABA neuróny narušená (3), v dôsledku čoho nedochádza k vyplaveniu inhibičných neurotransmiterov (4). Glutamát sa ale stále viaže na excitačné glutamátové neuróny a bez vplyvu inhibičných GABA neurónov (5) je do mozgového kmeňa vysielaný zosilnený signál (6).
V dôsledku toho sa na synapsiu vyplavuje príliš mnoho glutamátu, čo spôsobuje nadmernú stimuláciu dopaminergných neurónov a takisto ďalších inhibičných GABA neurónov (7).
Zvýšená stimulácia GABA neurónov nadmerne inhibuje rôzne dopaminergné neuróny, čím potláča ich aktivitu (8). Tieto nedostatočne aktivované dopaminergné neuróny prenášajú stredné signály z ventrálnej tegmentálnej oblasti do prefrontálneho kortexu, kde sa vyplavuje príliš málo dopamínu (9), čo vedie k hypodopaminergnému stavu v mezokortexe a následnej manifestácii negatívnych symptómov1.
Následne tieto nadmerne stimulované dopaminergné neuróny prenášajú silnejšie signály z ventrálnej tegmentálnej oblasti do ventrálneho striata, čo vedie k nadmernému vyplavovaniu dopamínu (10) a následnému nedostatku dopamínu v mezolimbickom systéme, čo vyvoláva pozitívne symptómy.
Literatúra: Upraveno podle Stahl SM. 4th ed. New York, NY: Cambridge University Press; 20131; Howes J Psychopharmacol. 2015 February; 29(2): 97–11529; Elert Nature volume 508, pages S2–S3 (03 April 2014)35;
Výskum svedčí o tom, že na vzniku pozitívnych symptómov sa podieľa zvýšený prenos dopamínu na D2 receptory v subkortikálnej a limbickej oblasti mozgu.31, 32
Ale mechanizmy, ktoré vedú k vzniku negatívnych a kognitívnych symptómov, nie sú také jasné.
V súčasnosti sa má za to, že znížené vyplavovanie dopamínu v prefrontálnom kortexe je spôsobené aktiváciou presynaptických dopamínových D3 autoreceptorov vo ventrálnej tegmentálnej oblasti s projekciou do prefrontálneho kortexu. Z podtypov dopamínových receptorov majú D3 receptory najvyššiu afinitu k dopamínu. Na rozdiel od D1 alebo D2 receptorov, môžu byť D3 receptory stimulované aj za podmienok nízkej miery vyplavovania dopamínu, čo môže „narúšať“ kolísavé účinky vĺn fázového vyplavovania dopamínu. Blokáda tohto útlmu bráni inhibícii vyplavovania dopamínu a zvyšuje neurotransmisiu. Toto zvýšenie dopamínu môže odvrátiť hypodopaminergný stav a viesť k zmierneniu negatívnych symptómov a kognitívnych funkcií cestou aktivácie D1 receptorov v prefrontálnom kortexe, ktoré nie sú aktívne za stavu s nízkym množstvom dopamínu.32
Pri zvieracích modeloch vrátane štúdií na primátoch boli najpriaznivejšie účinky na kognitívne funkcie dosiahnuté vtedy, keď bola optimalizovaná aktivita D1 receptorov v prefrontálnom kortexe. Príliš veľká aj príliš malá aktivita dopamínu na kôrových D1 receptoroch je spojená s kognitívnou dysfunkciou. Hypoteticky by teda lieky, ktoré blokujú alebo nadmerne stimulujú D1 receptory, mohli viesť k dysregulácii dopaminergnej stimulácie a podporovať kognitívne symptómy, negatívne symptómy a príznaky poruchy nálady, pretože vedú k nedostatočnej harmónii neurotransmisie na kôrových synapsiách. Je tiež možné, že by antagonisty D3 receptorov mohli viesť k dysinhibícii vyplavovania dopamínu a harmonizovať kôrové okruhy, čo by ďalej mohlo viesť k zlepšeniu regulácie kognitívnych funkcií, nálady a negatívnych symptómov.4
Literatúra
- Stahl, S. M. Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. (Cambridge University Press, 2013).
- Seeman, P. Schizophrenia and dopamine receptors. Eur. Neuropsychopharmacol. 23, 999–1009 (2013).
- Kaar, S. J., Natesan, S., McCutcheon, R. & Howes, O. D. Antipsychotics: Mechanisms underlying clinical response and side-effects and novel treatment approaches based on pathophysiology. Neuropharmacology (2019). doi:10.1016/j.neuropharm.2019.107704
- Stahl, S. M. Dazzled by the dominions of dopamine: Clinical roles of D3, D2, and D1 receptors. CNS Spectr. 22, 305–311 (2017).
- Cools, R. & D’Esposito, M. Inverted-U-shaped dopamine actions on human working memory and cognitive control. Biol. Psychiatry 69, e113-125 (2011).
- Hamid, A. A. et al. Mesolimbic dopamine signals the value of work. Nat. Neurosci. 19, 117-126. (2016).
- Koob, G. F., Caine, B., Markou, A., Pulvirenti, L. & Weiss, F. Role for the mesocortical dopamine system in the motivating effects of cocaine. NIDA Res. Monogr. Ser. 145, 1-18. (1994).
- Biesdorf, C. et al. Dopamine in the nucleus accumbens core, but not shell, increases during signaled food reward and decreases during delayed extinction. Neurobiol. Learn. Mem. 123, 125–139 (2015).
- Der-Avakian, A. & Markou, A. The neurobiology of anhedonia and other reward-related deficits. Trends Neurosci. 35, 68–77 (2012).
- Leggio, G. M., Micale, V. & Drago, F. Increased sensitivity to antidepressants of D3 dopamine receptor-deficient mice in the forced swim test (FST). Eur. Neuropsychopharmacol. 18, 271–277 (2008).
- Stahl, S. M. Describing an atypical antipsychotic: receptor binding and its role in pathophysiology. Prim. Care Companion J. Clin. Psychiatry 5, 9–13 (2003).
- Plowman, E. K., Thomas, N. J. & Kleim, J. A. Striatal dopamine depletion induces forelimb motor impairments and disrupts forelimb movement representations within the motor cortex. J. Parkinsons. Dis. 1, 93–100 (2011).
- Dichter, G. S., Damiano, C. A. & Allen, J. A. Reward circuitry dysfunction in psychiatric and neurodevelopmental disorders and genetic syndromes: Animal models and clinical findings. J. Neurodev. Disord. 4, 19 (2012).
- Ashok, A. H. et al. The dopamine hypothesis of bipolar affective disorder: The state of the art and implications for treatment. Mol. Psychiatry 22, 666–679 (2017).
- Orio, L., Wee, S., Newman, A. H., Pulvirenti, L. & Koob, G. F. The dopamine D3 receptor partial agonist CJB090 and antagonist PG01037 decrease progressive ratio responding for methamphetamine in rats with extended-access. Addict. Biol. 15, 312–323 (2010).
- Volkow, N. D. et al. Methylphenidate-elicited dopamine increases in ventral striatum are associated with long-term symptom improvement in adults with attention deficit hyperactivity disorder. J. Neurosci. 32, 841–849 (2012).
- Beaulieu, J. M., Espinoza, S. & Gainetdinov, R. R. Dopamine receptors – IUPHAR review 13. Br. J. Pharmacol. 172, 1–23 (2015).
- Sunahara, R. K. et al. Cloning of the gene for a human dopamine D5 receptor with higher affinity for dopamine than D1. Nature 350, 614–619 (1991).
- Toll, L. et al. Standard binding and functional assays related to medications development division testing for potential cocaine and opiate narcotic treatment medications. NIDA Res. Monogr 178, 440–466 (1998).
- Michaelides, M. R. et al. (5aR, 11bS)-4,5,5a,6,7, 11b-hexahydro-2-propyl-3-thia-5-azacyclopent-1-ena[c]-phenanthrene-9,10-diol (A-86929): A potent and selective dopamine D1 agonist that maintains behavioral efficacy following repeated administration and characterization of its dia. J. Med. Chem. 38, 3445–3447 (1995).
- Tallman, J. F. et al. Ngd 94-1 – identification of a noval, high-affinity antagonist at the human dopamine D-4 receptor 1. J. Pharmacol Exp Ther 282, 1011–1019 (1997).
- Stahl, S. M. Mechanism of action of cariprazine. CNS Spectr. 21, 123–127 (2016).
- Gurevich, E. V. & Joyce, J. N. Distribution of dopamine D3 receptor expressing neurons in the human forebrain comparison with D2 receptor expressing neurons. Neuropsychopharmacology 20, 60–80 (1999).
- Mengod, G. et al. Visualization of dopamine D1, D2 and D3 receptor mRNA’s in human and rat brain. Neurochem. Int. 20, Suppl:33S-43S (1992).
- Meador-Woodruff, J. H. et al. Dopamine receptor mRNA expression in human striatum and neocortex. Neuropsychopharmacology 15, 17–29 (1996).
- Fuxe, K. et al. Dopaminergic Systems in the Brain and Pituitary. in Basic and Clinical Aspects of Neuroscience (eds. Flückinger, E., Müller, E. E. & Thorner, M. O.) (Springer, 1985). doi:10.1007/978-3-642-69948-1_2
- Fatemi, S. H. & Clayton, P. J. The medical basis of psychiatry: Fourth edition. The Medical Basis of Psychiatry: Fourth Edition (2016). doi:10.1007/978-1-4939-2528-5
- Howes, O. D. & Kapur, S. The dopamine hypothesis of schizofrenie: Version III – The final common pathway. Schizophr. Bull. 35, 549–562 (2009).
- Howes, O., McCutcheon, R. & Stone, J. Glutamate and dopamine in schizofrenie: An update for the 21st century. J. Psychopharmacol. 29, 97–115 (2015).
- Desbonnet, L. Modeling the Psychopathological Dimensions of Schizophrenia. in Handbook of Behavioural Neuroscience 267–284 (2016).
- Toda, M. & Abi-Dargham, A. Dopamine hypothesis of schizofrenie: Making sense of it all. Curr. Psychiatry Rep. 9, 329–336 (2007).
- Stahl, S. M. Drugs for psychosis and mood: Unique actions at D3, D2, and D1 dopamine receptor subtypes. CNS Spectr. 22, 375–384 (2017).
- Grace, A. A. & Gomes, F. V. The circuitry of dopamine system regulation and its disruption in schizofrenie: Insights into treatment and prevention. Schizophr. Bull. 45, 148–157 (2019).
- Grace, A. A. Dysregulation of the dopamine system in the pathophysiology of schizofrenie and depression. Nat. Rev. Neurosci. 17, 524–532 (2016).
- Elert, E. Aetiology: Searching for schizofrenie’s roots. Nature 508, S2-3 (2014).
CNS Spectrums
Dazzled by the dominions of dopamine: clinical roles of D3, D2, and D1 receptors.
ANTIPSYCHOTIKÁ, RÔZNE MECHANIZMY ÚČ…ANTIPSYCHOTIKÁ, RÔZNE MECHANIZMY ÚČ…
Profil klinickej účinnosti typických antipsychotík zrejme závisí od vysokej afinity a plného antagonisticProfil klinickej účinnosti typických antipsychotík zrejme závisí od vysokej afinity a plného antagonistického účinku na dopamínové D2 receptory. Vzhľadom na väz
viac…AKO LIEK REAGILA PÔSOBÍ?AKO NÁŠ LIEK PÔSOBÍ?
Kariprazín má vysokú afinitu k dopamínovým D3 a D2 receptorom a tiež k sérotonínovým 5 HT2B a 5 HT1A receViac informácií o mechanizme účinku
viac…