Mechanizmus účinku lieku REAGILA
- Mechanizmus účinku kariprazínu nie je presne známy.1
- Terapeutický účinok kariprazínu môže byť sprostredkovaný kombináciou parciálne agonistického pôsobenia na dopamínových D3 a D2 receptoroch a sérotonínových 5‑HT1A receptoroch a antagonistického pôsobenia na sérotonínových 5‑HT2B receptoroch.1
- Kariprazín má nízku afinitu k sérotonínovým 5‑HT2C a adrenergným α1 receptorom a žiadnu zjavnú afinitu k cholinergným muskarínovým receptorom.1
- Kariprazín má dva hlavné aktívne metabolity, desmetyl‑kariprazín a didesmetyl‑kariprazín, ktoré majú podobný profil in vitro väzieb na receptory a funkčnú aktivitu ako materský liek.1
V tejto časti
Mechanizmus účinku všetkých antipsychotík vrátane kariprazínu nie je úplne známy.1 Ale na základe jeho receptorového profilu a množstva štúdií zahŕňajúcich in vivo predklinické štúdie a štúdie s PET na ľuďoch máme dostatok dôkazov, ktoré objasňujú hlavné faktory podieľajúce sa na jeho mechanizme účinku.
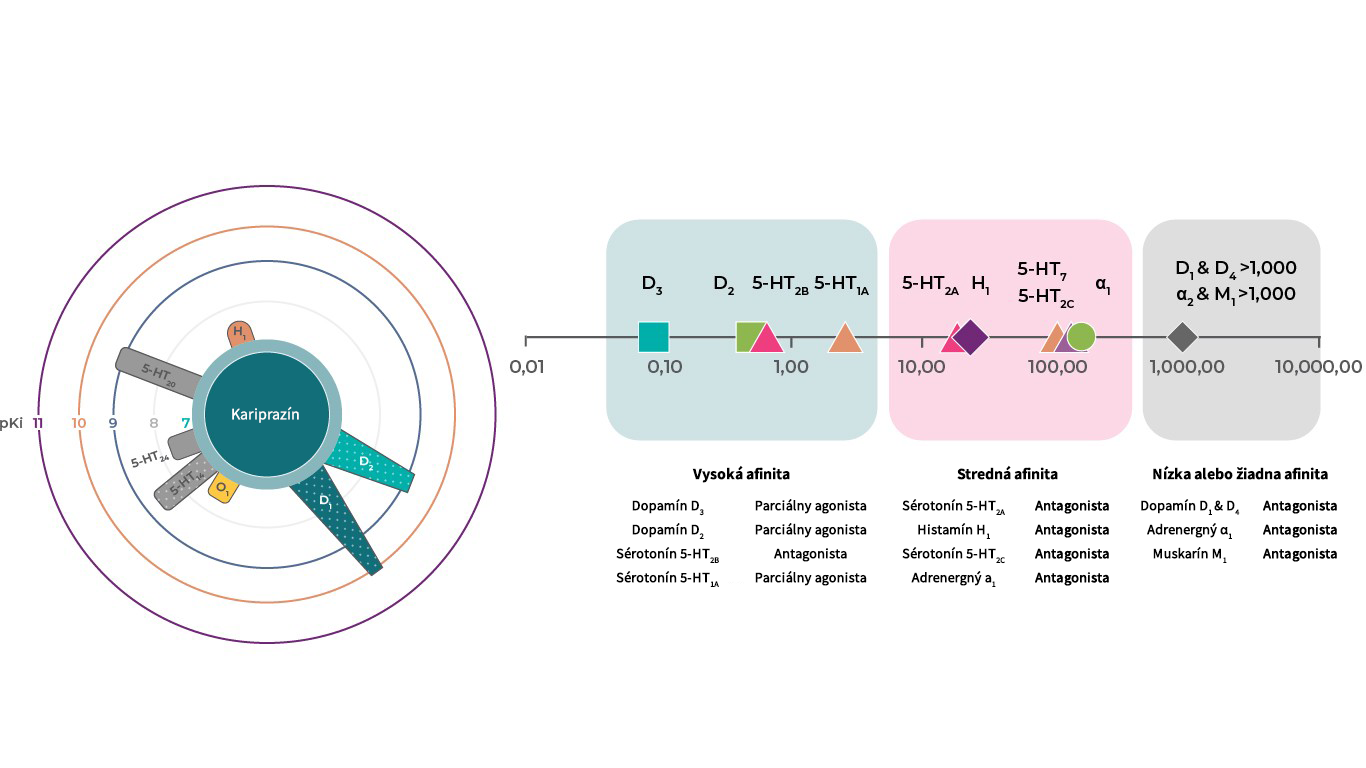
Receptorový profil kariprazínu
Kariprazín má vysokú afinitu k dopamínovým D3 a D2 receptorom a tiež k sérotonínovým 5‑HT2B a 5‑HT1A receptorom, strednú afinitu k 5‑HT2A, histamínovým H1 a sigma σ1
receptorom, nízku afinitu k sérotonínovým 5‑HT2C a adrenergným α1 receptorom a žiadnu zjavnú afinitu k cholinergným muskarínovým receptorom.1, 2 Predpokladá sa, že terapeutický účinok kariprazínu je sprostredkovaný kombináciou jeho parciálne agonistického pôsobenia na dopamínových D3, D2 a sérotonínových 5‑HT1A receptoroch a antagonistického pôsobenia na 5‑HT2B receptoroch.1
Literatúra: Upraveno podle Kiss. J Pharmacol Exp Ther 2010.333:328–340; Partial agonism is represented with dots, circles show pKi values.2
Antipsychotiká sú vo všeobecnosti považované za účinné proti pozitívnym symptómom schizofrénie, zatiaľ čo v liečbe kognitívneho deficitu a negatívnych symptómov spojených so schizofréniou je ich účinnosť nižšia. Výsledky na zvieracích modeloch naznačujú, že pri regulácii kognície, nálady a sociálnych funkcií hrajú dôležitú rolu dopamínové D3 receptory.3 Najnovšie dostupné antipsychotiká majú nižšiu afinitu k D3 receptorom voči relatívne vysokej afinite samotného dopamínu k D3 receptorom, čo je dôvod, prečo neobsahujú dopamínové D3 receptory v živom mozgu.3 Na druhej strane je kariprazín medzi antipsychotikami jedinečný tým, že má väčšiu väzobnú silu k D3 receptorom než samotný dopamín, čo znamená, že dôsledkom podania kariprazínu je blokáda D3 receptorov.4 – 8 Blokáda D3 receptorov má hypoteticky u pacientov so schizofréniou prokognitívne a antidepresívne účinky a takisto účinky proti negatívnym symptómom.3 Kariprazín preukázal účinnosť pri behaviorálnych predklinických modeloch negatívnych symptómov, symptómov porúch nálady a zhoršenia kognitívnych funkcií.9 – 14 Účinnosť bola pri týchto zvieracích modeloch minimálne sčasti závislá od jeho aktivity na dopamínových D3 receptoroch, pretože jeho účinky na anhedóniu a zhoršenie kognitívnych funkcií boli zjavné u myší divokého typu, ale nie u myší s vyradenými D3 receptormi.10, 14
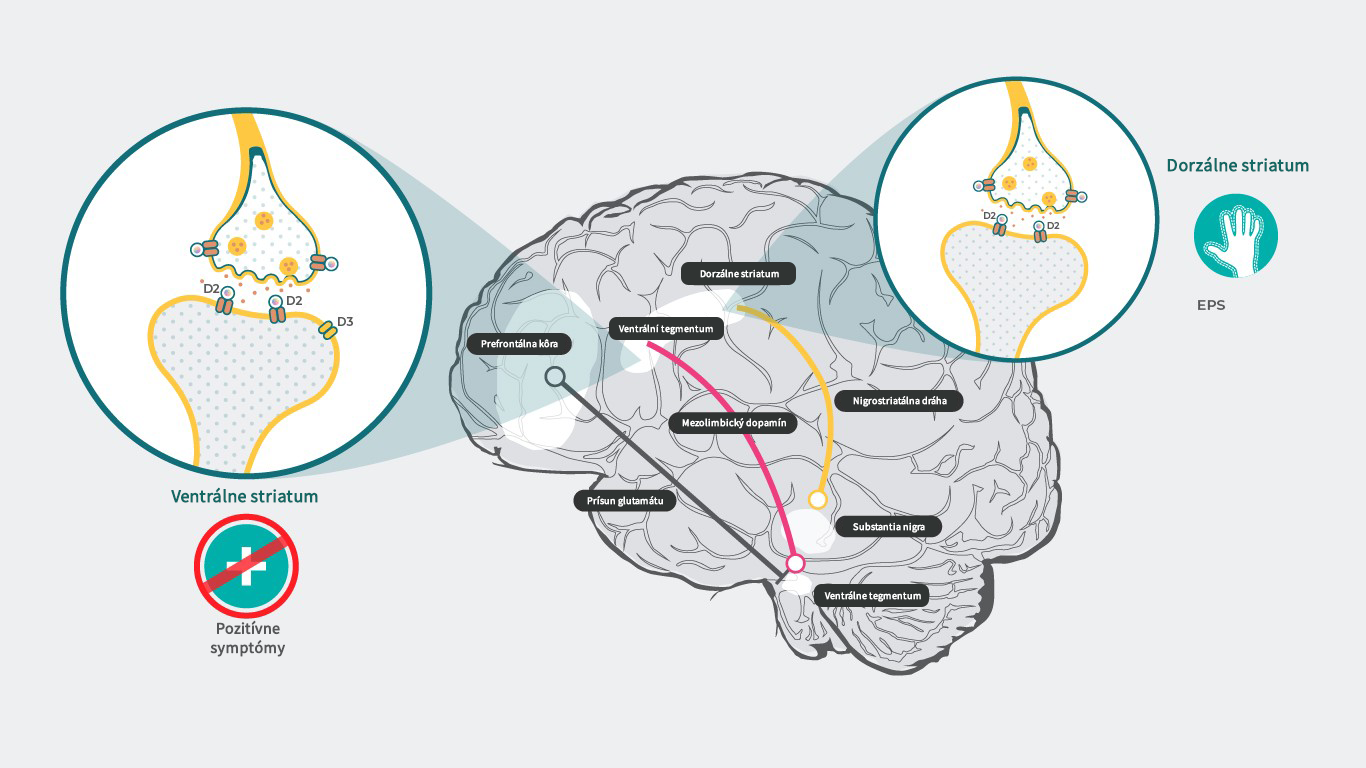
Obsadenosť receptorov kariprazínom
Vo farmakologicky účinných dávkach vykázal kariprazín relatívne malú obsadenosť D3 aj D2 receptorov, ako preukázali neklinické štúdie in vivo a štúdie s PET na ľuďoch.15 U pacientov so schizofréniou bola pri dávkach kariprazínu v terapeutickom rozmedzí pozorovaná od dávky závislá obsadenosť dopamínových D3 a D2 receptorov.1 V oblastiach mozgu s vyššou expresiou D3 receptorov vykázal kariprazín väčšiu preferenčnú obsadenosť D3 receptorov ako D2 receptorov.15 Afinita k D3 receptorom je u mnohých liekov približne rovnaká ako ich afinita k D2 receptorom, je však väčšinou nižšia ako afinita dopamínu k D3 receptorom.3 Preto účinky pripisované blokáde D3 receptorov nemôžu byť spojené s žiadnym iným liekom než s kariprazínom, pretože v živom mozgu v prítomnosti prirodzeného dopamínu žiadne iné antipsychotikum než kariprazín D3 receptory neblokuje.3, 4 Pokiaľ ide o bezpečnosť, u parciálneho agonistu by potenciálne nemalo dochádzať k blokáde nigrostriatálnej alebo tuberoinfundibulárnej dráhy, ktorá je spojená s extrapyramídovými symptómami (EPS) a zvýšenou hladinou prolaktínu.16 Takže teoreticky by mal kariprazín vyvolávať menej vedľajších účinkov tohto typu. Ale v klinických štúdiách sa preukázalo, že to platí o hladine prolaktínu, ktorá sa v odpovedi na podanie kariprazínu nezvyšuje,17 bolo však pozorované zvýšenie incidencie EPS/akatízie,17 pre ktoré nie je jasné vysvetlenie.16
Literatúra: Upraveno podle Stahl SM. CNS Spectrums (2017), 22, 375–384.3 ; Howes J Psychopharmacol. 2015 February; 29(2): 97–115.18
In vitro vykazuje kariprazín účinky parciálneho agonistu D3 receptorov.1 Vzhľadom na to, že väčšina D3 receptorov sa nachádza v oblastiach mozgu, kde je pri schizofrénii hyperdopaminergný stav (t. j. v mezolimbickom dopaminergnom systéme),15, 18 pôsobí kariprazín na tieto receptory ako funkčný antagonista. Antagonistické pôsobenie na D3
receptory je spojené s prokognitívnymi a antidepresívnymi účinkami a účinkami proti negatívnym symptómom.3 Mätúce je, že rovnaké účinky tiež súvisia s kôrovými funkciami, kde je pri schizofrénii hypodopaminergný stav.18 Vyvstáva tu teda otázka, ako kariprazín normalizuje tento hypodopaminergný stav blokádou D3 receptorov?
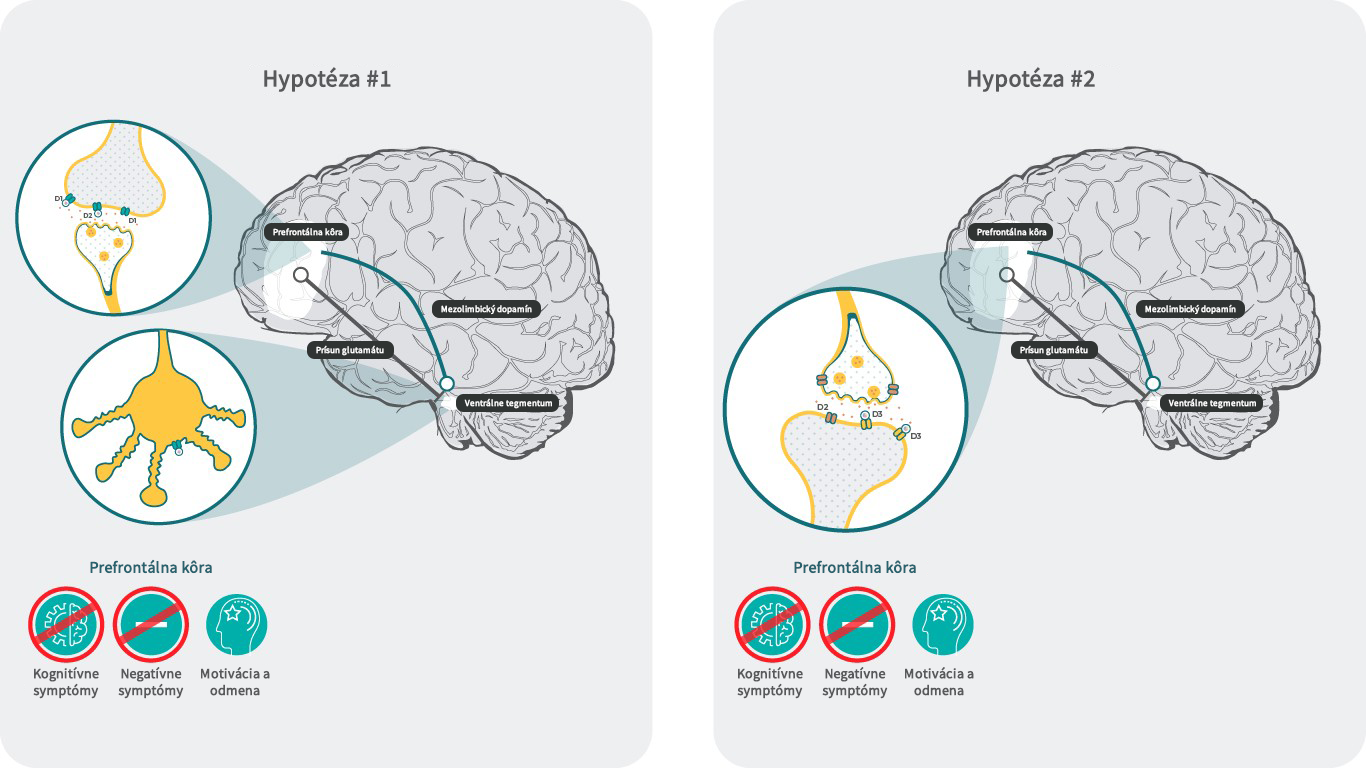
1. hypotéza: Literatúra: Upraveno podle Howes J Psychopharmacol. 2015 February; 29(2): 97–115.18; Stahl SM. CNS Spectrums (2017), 22, 375–384.3
2. hypotéza: Literatúra: Adapted from Bouthenet et al. Brain research 1991.564, 203-21928; Gurevich, Neuropsychopharmacology 1999. 20, 60-80.29; Loiseau, Eur Neuropsychopharmacol 2009.19, 23-33.30; Watson, D.J. Neuropsychopharmacology 2012.37, 770-786.31; Clarkson, J Neurosci 2017.37, 5846-5860.32; Yang, S. Cell Rep 2016.16, 1518-1526.33; Neill, J.C. Eur Neuropsychopharmacol 2016. 26, 3-14.11; Zimnisky, R. Psychopharmacology (Berl) 2013.226, 91-100.14
Hypotéza č. 1: Zvýšená neurotransmisia z VTA do PFC
Negatívne symptómy a zhoršenie kognitívnych funkcií sú spojené s hypodopaminergným stavom v prefrontálnom kortexe (PFC).18 Príčinou toho môže byť znížené vyplavovanie dopamínu v PFC z dôvodu aktivácie presynaptických dopamínových D3 autoreceptorov vo ventrálnej tegmentálnej oblasti (VTA) s projekciou do PFC3. Predpokladá sa, že za týchto podmienok môže antagonista/parciálny agonista D3 receptorov blokovať inhibíciu týchto neurónov, čo ďalej vedie k zvýšeniu hladiny dopamínu v PFC a normalizuje hypodopaminergný stav.3 Zvýšenie dopamínu môže zvrátiť hypodopaminergný stav a viesť k zmierneniu negatívnych symptómov a zlepšeniu kognície prostredníctvom aktivácie D1 receptorov v PFC, ktoré nie sú pri nízkej hladine dopamínu aktívne z dôvodu nízkej aktivity dopamínu k týmto receptorom.3
Aj keď presný mechanizmus účinku kariprazínu a ani iných antipsychotík stále nie je známy, výsledky predklinických pokusov s kariprazínom túto hypotézu príliš nepodporujú.19 – 26 Je však možné, že u ľudí sú účinky iné, pretože mechanizmus a funkčné dôsledky somatodendritickej dopamínovej transmisie vo VTA sa podľa publikovaných prác u rôznych druhov líšia. Možno očakávať, že in vivo budú mať tieto rozdiely vplyv na aktivitu mezokortikolimbického dopamínového systému a následné terminálne vyplavenie.27
Hypotéza č. 2: Postsynaptická väzba na D3 receptory v PFC
Aj napriek relatívne nízkej expresii D3 receptorov v PFC28 – 29 dôkazy naznačujú, že D3 receptory v PFC môžu modulovať funkciu PFC a vplývať na kogníciu.5, 6
U hlodavcov viedli lokálne infúzie antagonistov D3 receptorov do PFC k účinnosti zvieracích modelov negatívnych symptómov a narušenia kognície. Účinnosť nebola pozorovaná v nucleus accumbens (NAc) ani v striate,30, 31 čo naznačuje, že antagonistické pôsobenie na D3 receptoroch má lokálne v PFC prokognitívne účinky. Schopnosť D3 receptorov modulovať náladu a kognitívne funkcie aj napriek nízkej expresii môže súvisieť so špecializovaným umiestnením D3 receptorov v PFC. Ukázalo sa, že D3 receptory hrajú významnú rolu v regulácii excitability v 5. vrstve pyramídových buniek v PFC32. V ďalšej štúdii sa zistilo, že agonisty D3
receptorov potláčajú excitabilitu kanálu Cav3 iniciálneho segmentu axónu mechanizmom závislým od arestínu.33 Spoločne tieto výsledky naznačujú, že antagonistické pôsobenie kariprazínu na postsynaptických D3 receptoroch v PFC by mohlo prispievať k účinnosti na negatívne symptómy a kogníciu moduláciou potenciálov glutamátových neurónov a transmisie glutamátu. To ďalej podporujú aj priaznivé zistenia, že kariprazín dokázal v zvieracích behaviorálnych modeloch odvrátiť kognitívne zhoršenie navodené PCP.11, 14
Metabolity kariprazínu
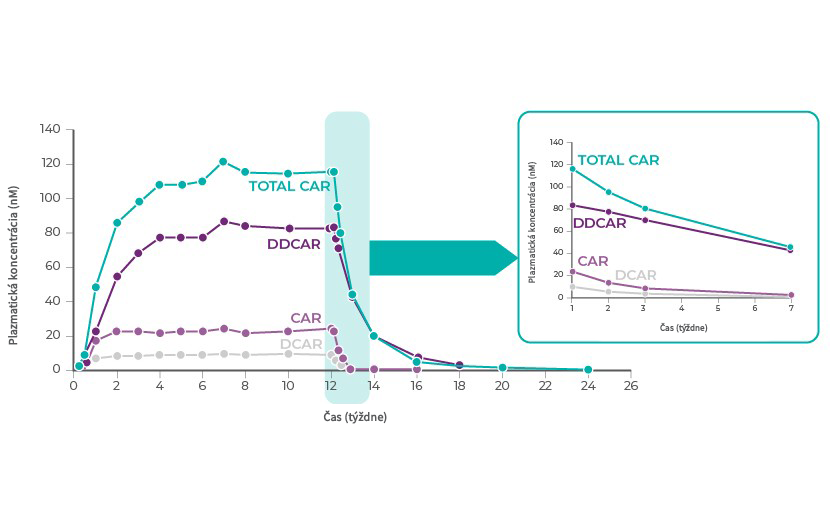
Kariprazín má dva farmakologicky aktívne metabolity, ktorých aktivita je podobná kariprazínu – desmetyl‑kariprazín (DCAR) a didesmetyl‑kariprazín (DDCAR).1 Celková expozícia kariprazínu (molárny súčet kariprazínu s DCAR a DDCAR) sa blíži 50 % expozície v ustálenom stave približne po 1 týždni každodenného podávania a 90 % ustáleného stavu je dosiahnutých po 3 týždňoch.
V ustálenom stave je expozícia DDCAR približne 2-krát až 3-krát vyššia ako expozícia kariprazínu a expozícia DCAR predstavuje približne 30 % expozície kariprazínu.1
Kariprazín, DCAR a DDCAR sú primárne vylučované metabolizmom pečene (CYP3A4 a CYP2D6).
Polčas účinnosti je asi 2 dni pri kariprazíne a DCAR, 8 dní pri DDCAR a ~1 týždeň pri celkovom kariprazíne. Plazmatická koncentrácia celkového kariprazínu po vysadení dávkovania postupne klesá, pričom pokles o 50 % je dosiahnutý približne za 1 týždeň a pokles > 90 % za 3 týždne.1
Literatúra: Upraveno podle Nakamura, T. et al. Clinical pharmacology study of cariprazine (MP-214) in patients with schizofrenie (12-week treatment). Drug Des. Devel. Ther. 10, 327–338 (2016)34.
Literatúra
- Reagila SmPC.
- Kiss, B. et al. Cariprazine (RGH-188), a dopamine D3 receptor-preferring, D 3/D2 dopamine receptor antagonist-partial agonist antipsychotic candidate: In vitro and neurochemical profile. J. Pharmacol. Exp. Ther. 333, 328–340 (2010).
- Stahl, S. M. Drugs for psychosis and mood: Unique actions at D3, D2, and D1 dopamine receptor subtypes. CNS Spectr. 22, 375–384 (2017).
- Stahl, S. M. Mechanism of action of cariprazine. CNS Spectr. 21, 123–127 (2016).
- Gross, G. & Drescher, K. The role of dopamine D 3 receptors in antipsychotic activity and cognitive functions. in Handbook of Experimental Pharmacology (eds. Geyer, M. A. & Gross, G.) 168–210 (2012). doi:10.1007/978-3-642-25758-2_7
- Nakajima, S. et al. The potential role of dopamine D3 receptor neurotransmission in cognition. Eur. Neuropsychopharmacol. 23, 799–813 (2013).
- Leggio, G. M., Bucolo, C., Platania, C. B. M., Salomone, S. & Drago, F. Current drug treatments targeting dopamine D3 receptor. Pharmacol. Ther. 165, 164–177 (2016).
- Ellenbroek, B. A. & Cesura, A. M. Antipsychotics and the dopamine–serotonin connection. in Topics in Medicinal Chemistry (eds. Celanire, S. & Poli, S.) 13, 1–49 (Springer, Cham, 2014).
- Barnes, S. A. et al. The Effects of Cariprazine and Aripiprazole on PCP-Induced Deficits on Attention Assessed in the 5-Choice Serial Reaction Time Task. Psychopharmacology (Berl). 235, 1403–1414 (2018).
- Duric, V. et al. Cariprazine exhibits anxiolytic and dopamine D3 receptor-dependent antidepressant effects in the chronic stress model. Int. J. Neuropsychopharmacol. 20, 788–796 (2017).
- Neill, J. C. et al. Effects of cariprazine, a novel antipsychotic, on cognitive deficit and negative symptoms in a rodent model of schizofrenie symptomatology. Eur. Neuropsychopharmacol. 26, 3–14 (2016).
- Papp, M. et al. Attenuation of anhedonia by cariprazine in the chronic mild stress model of depression. Behav. Pharmacol. 25, 567–574 (2014).
- Watson, D. J. G. et al. The dopamine D 3 -preferring D 2 /D 3 dopamine receptor partial agonist, cariprazine, reverses behavioural changes in a rat neurodevelopmental model for schizofrenie. Eur. Neuropsychopharmacol. 26, 208–224 (2016).
- Zimnisky, R. et al. Cariprazine, a dopamine D3-receptor-preferring partial agonist, blocks phencyclidine-induced impairments of working memory, attention set-shifting, and recognition memory in the mouse. Psychopharmacology (Berl). 226, 91–100 (2013).
- Girgis, R. R. et al. Preferential binding to dopamine D3 over D2 receptors by cariprazine in patients with schizofrenie using PET with the D3/D2 receptor ligand [11C]-(+)-PHNO. Psychopharmacology (Berl). 233, 3503–3512 (2016).
- Lieberman, J. A. Dopamine partial agonists: A new class of antipsychotic. CNS Drugs 18, 251–267 (2004).
- Nasrallah, H. A. et al. The safety and tolerability of cariprazine in long-term treatment of schizofrenie: A post hoc pooled analysis. BMC Psychiatry (2017) doi:10.1186/s12888-017-1459-z.
- Howes, O., McCutcheon, R. & Stone, J. Glutamate and dopamine in schizofrenie: An update for the 21st century. J. Psychopharmacol. 29, 97–115 (2015).
- Kehr, J. et al. Effects of cariprazine on extracellular levels of glutamate, GABA, dopamine, noradrenaline and serotonin in the medial prefrontal cortex in the rat phencyclidine model of schizofrenie studied by microdialysis and simultaneous recordings of locomotor acti. Psychopharmacology (Berl). 235, 1593–1607 (2018).
- Gobert, A. et al. Functional correlates of dopamine D3 receptor activation in the rat in vivo and their modulation by the selective antagonist, (+)-S 14297: II. Both D2 and ‘silent’ D3 autoreceptors control synthesis and release in mesolimbic, mesocortical and nigrostriata. J. Pharmacol. Exp. Ther. 275, 899–913 (1995).
- Millan, M. J. et al. S18616, a highly potent spiroimidazoline agonist at α2-adrenoceptors: II. Influence on monoaminergic transmission, motor function, and anxiety in comparison with dexmedetomidine and clonidine. J. Pharmacol. Exp. Ther. 295, 1206–1222 (2000).
- Reavill, C. et al. Pharmacological actions of a novel, high-affinity, and selective human dopamine D 3 receptor antagonist, SB-277011-A. J. Pharmacol. Exp. Ther. 294, 1154–1165 (2000).
- Delcourte, S. et al. The novel atypical antipsychotic cariprazine demonstrates dopamine D2 receptor-dependent partial agonist actions on rat mesencephalic dopamine neuronal activity. CNS Neurosci. Ther. 24, 1129–1139 (2018).
- Etievant, A., Bétry, C., Arnt, J. & Haddjeri, N. Bifeprunox and aripiprazole suppress in vivo VTA dopaminergic neuronal activity via D2 and not D3 dopamine autoreceptor activation. Neurosci. Lett. 460, 82–86 (2009).
- Koeltzow, T. E. et al. Alterations in dopamine release but not dopamine autoreceptor function in dopamine D3 receptor mutant mice. J. Neurosci. 18, 2231–2238 (1998).
- Tepper, J. M., Sun, B. C., Martin, L. P. & Creese, L. Functional roles of dopamine D2 and D3 autoreceptors on nigrostriatal neurons analyzed by antisense knockdown in vivo. J. Neurosci. 17, 2519–2530 (1997).
- Courtney, N. A., Mamaligas, A. A. & Ford, C. P. Species differences in somatodendritic dopamine transmission determine D2-autoreceptor-mediated inhibition of ventral tegmental area neuron firing. J. Neurosci. 32, 13520–13528 (2012).
- Bouthenet, M. L. et al. Localization of dopamine D3 receptor mRNA in the rat brain using in situ hybridization histochemistry: comparison with dopamine D2 receptor mRNA. Brain Res. 564, 203–219 (1991).
- Gurevich, E. V. & Joyce, J. N. Distribution of dopamine D3 receptor expressing neurons in the human forebrain comparison with D2 receptor expressing neurons. Neuropsychopharmacology 20, 60–80 (1999).
- Loiseau, F. & Millan, M. J. Blockade of dopamine D3 receptors in frontal cortex, but not in sub-cortical structures, enhances social recognition in rats: Similar actions of D1 receptor agonists, but not of D2 antagonists. Eur. Neuropsychopharmacol. 19, 23–33 (2009).
- Watson, D. J. G. et al. Selective blockade of dopamine D 3 receptors enhances while D 2 receptor antagonism impairs social novelty discrimination and novel object recognition in rats: A key role for the prefrontal cortex. Neuropsychopharmacology 37, 770–786 (2012).
- Clarkson, R. L., Liptak, A. T., Gee, S. M., Sohal, V. S. & Bender, K. J. D3 receptors regulate excitability in a unique class of prefrontal pyramidal cells. J. Neurosci. 37, 5846–5860 (2017).
- Yang, S. et al. β-Arrestin-Dependent Dopaminergic Regulation of Calcium Channel Activity in the Axon Initial Segment. Cell Rep. 16, 1518–1526 (2016).
- Nakamura, T. et al. Clinical pharmacology study of cariprazine (MP-214) in patients with schizofrenie (12-week treatment). Drug Des. Devel. Ther. 10, 327–338 (2016).
CNS Spectrums
Mechanism of action of cariprazine.
Teda, vzhľadom na to, že kariprazín je jedinečné antipsychotikum, pretože má vyššiu silu pre D3 receptory ako samotný dopamín (obr. 3),3 – 5 čistým účinkom podania kariprazínu je blokáda D3 receptorov.“
LIEK REAGILA PRI LIEČBE AKÚTNEJ SCH…NÁŠ LIEK PRI LIEČBE AKÚTNEJ SCHIZOF…
Keď je stanovená diagnóza schizofrénie, musia lekári, pacienti a rodinní príslušníci urobiť dôležité rozhKeď je stanovená diagnóza schizofrénie, musia lekári, pacienti a rodinní príslušníci urobiť dôležité rozhodnutie o terapii. Aj keď si každý intuitívne uvedomuje
viac…LIEK REAGILA A KAŽDODENNÉ FUNGOVANI…NÁŠ LIEK A KAŽDODENNÉ FUNGOVANIE
U pacientov so schizofréniou musí byť zmiernenie negatívnych symptómov sprevádzané zlepšením fungovania pU pacientov so schizofréniou musí byť zmiernenie negatívnych symptómov sprevádzané zlepšením fungovania pacienta, aby mohla byť zmena považovaná za klinicky rel
viac…